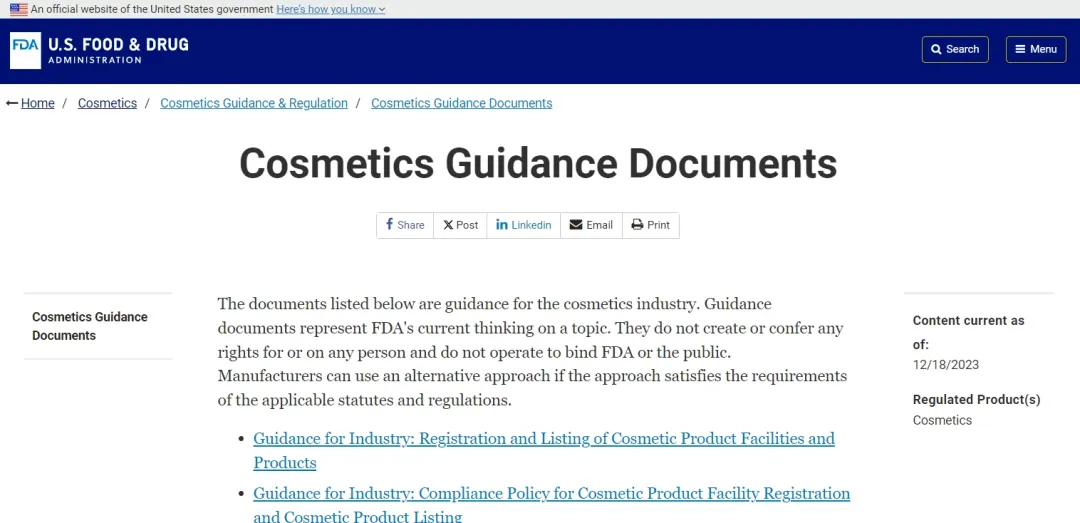
Nedávno FDA vydala konečné pokyny pro seznam kosmetických zařízení a produktů a spustila nový kosmetický portál s názvem 'Cosmetic Direct'. A FDA oznámila povinné požadavky na registraci kosmetických zařízení a seznam produktů počínaje 1. červencem 2024, aby zajistila, že regulované podniky budou mít dostatek času na přípravu a odeslání informací.
1. Předpisy
1) Modernizace zákona o regulaci kosmetiky z roku 2022 (MoCRA)
2)Federální zákon o potravinách, léčivech a kosmetice (zákon FD&C)
3) Zákon o spravedlivém balení a označování (FPLA)
2. Rozsah použití
Podle zákonů USA je kosmetika definována jako předměty, které se aplikují, roztírají, stříkají nebo jinak používají na lidské tělo za účelem čištění, zkrášlení, zvýšení atraktivity nebo změny vzhledu.
Konkrétně se jedná o hydratační krém na pokožku, parfém, rtěnku, lak na nehty, oční a obličejovou kosmetiku, čistící šampon, trvalou, barvy na vlasy a deodoranty a také jakékoli látky používané jako kosmetické přísady. Mýdlo do kosmetiky nepatří.
3. Klasifikace
Podle MoCRA klasifikuje americká kosmetika FDA kosmetiku do následujících kategorií:
- Dětské produkty: včetně dětského šamponu, mastku pro péči o pokožku, krému na obličej, oleje a tekutiny.
-Produkty do koupele: včetně koupelové soli, oleje, léku, pěnidla, koupelového gelu atd.
-Oční kosmetika: jako je tužka na obočí, oční linky, oční stíny, mytí očí, odstraňovač očního make-upu, oční čerň atd.
Kosmetika se speciálními účinky, jako je proti vráskám, bělení, hubnutí atd., musí být zároveň registrována jako volně prodejná léčiva. Je třeba poznamenat, že tyto nové předpisy se vztahují na kosmetiku vyváženou na americký trh.
registrace FDA
MoCRA nejen přidalo následující nové požadavky, včetně zavedení systému odpovědných osob za kosmetiku, povinného hlášení závažných nežádoucích účinků, dodržování správné výrobní praxe (GMP), registrace výrobního závodu a registrace na seznam produktů, poskytnutí dostatečných bezpečnostních certifikátů, ale také požadoval, aby štítek byl označen informacemi o odpovědné osobě, alergeny esence, profesionálním používáním prohlášení o výrobku, vývojem a uvolňováním metod detekce azbestu v kosmetice obsahujících mastek a hodnocením bezpečnostních rizik a testem postupného vyřazování PFAS v kosmetice.
Před implementací MOCRA mohou výrobci/balírny kosmetiky zaregistrovat svá tovární zařízení u FDA prostřednictvím programu Dobrovolné registrace kosmetiky (VCRP) amerického FDA a FDA pro to nemá povinné požadavky.
Ale s implementací MOCRA a blížícím se povinným termínem musí všechny společnosti prodávající kosmetiku ve Spojených státech zaregistrovat svá výrobní zařízení u FDA a každé dva roky aktualizovat své registrační údaje, včetně jména, kontaktních údajů atd. Zařízení umístěná mimo Spojené státy Státy jsou také povinny poskytnout informace a kontaktní údaje agentů ve Spojených státech. Jsou zde také některé doplňující informace, které je třeba vyplnit, jako jsou informace o mateřské společnosti, typ podniku, obrázky balení, odkazy na webové stránky produktu, zda se jedná o profesionální kosmetiku, kód Dun&Bradstreet odpovědné osoby atd. Vyplnění není povinné. Stávající kosmetická zařízení se musí zaregistrovat u FDA do jednoho roku po vydání nových předpisů a registrační období pro nová kosmetická zařízení je do 60 dnů od zahájení kosmetického zpracování a výroby.
BTF Testing Lab, naše společnost disponuje laboratořemi elektromagnetické kompatibility, bezpečnostními předpisy Laboratoř, Laboratoř bezdrátových rádiových frekvencí, Laboratoř baterií, Chemická Laboratoř, Laboratoř SAR, Laboratoř HAC atd. Získali jsme kvalifikace a oprávnění jako CMA, CNAS, CPSC, VCCI, atd. Naše společnost má zkušený a profesionální technický inženýrský tým, který může podnikům pomoci vyřešit problém. Máte-li relevantní požadavky na testování a certifikaci, můžete přímo kontaktovat naše testovací pracovníky a získat podrobné cenové nabídky a informace o cyklech!

Testovací zpráva FDA
Čas odeslání: 21. srpna 2024